バイオシミラーについて
バイオ医薬品とは
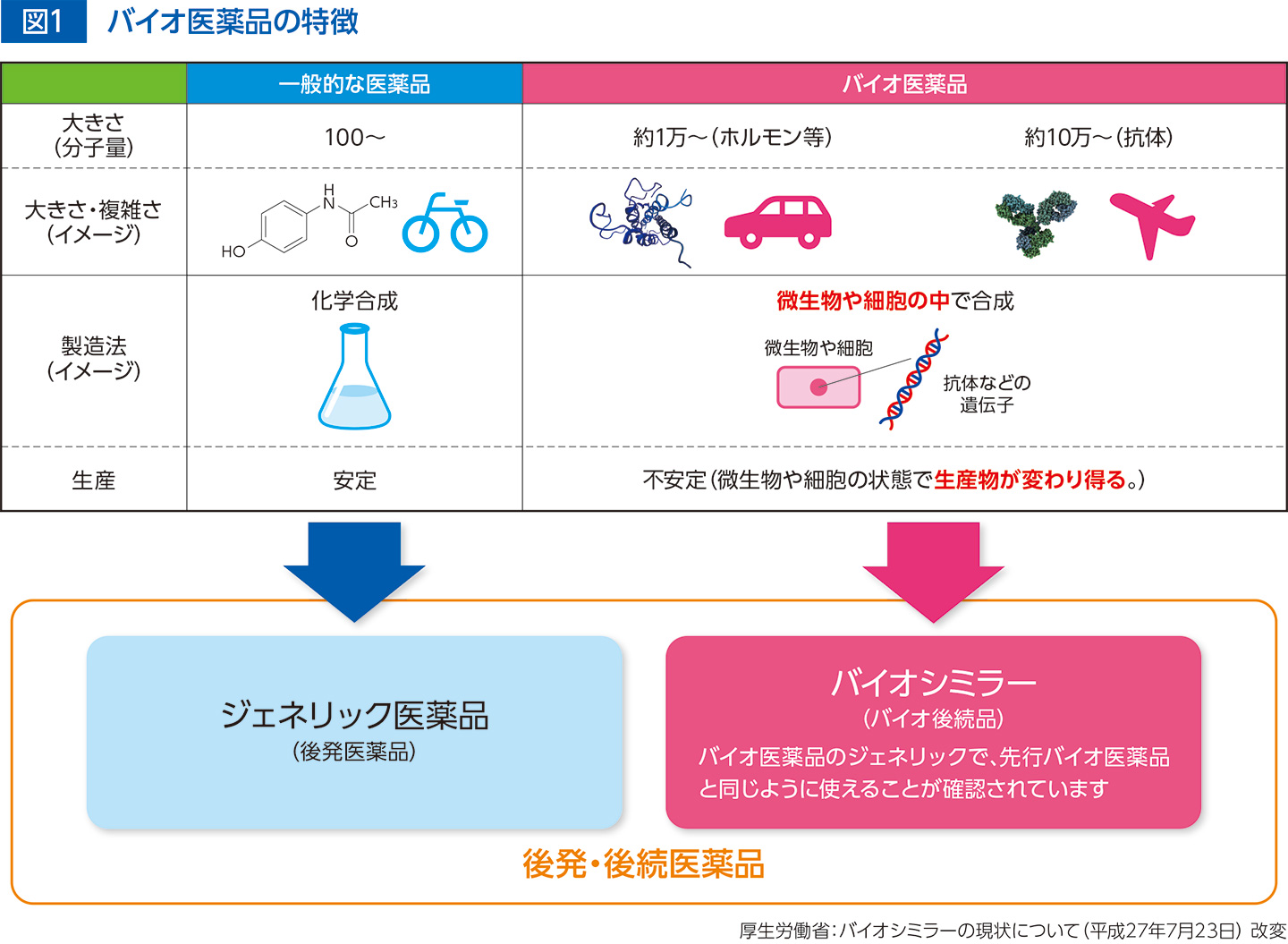
バイオ医薬品は、生体による生合成過程を利用して製造され、ホルモン製剤や抗体製剤といった分子量が非常に大きく複雑な構造を持ちます。バイオ医薬品は培養条件などの変化に敏感な微生物や動物細胞等を用いて作られ、これらの状態により生産物が変わる可能性があるため、厳密な製造工程の管理が求められます。また、化学合成で製造される一般的な医薬品とは異なり、バイオ医薬品は微生物や細胞の中で起こる生合成反応を製造に利用しているため、製造ロット間で物理的化学的性質・生物学的性質にバラツキが生じます(図1)。
バイオシミラーとは
先行バイオ医薬品と同等/同質の品質、安全性および有効性を有し、異なる製造販売業者により開発される医薬品をバイオシミラー(バイオ後続品)と言います。
バイオシミラーは、先行バイオ医薬品と品質がほとんど同じで、同じ効果と安全性が確認された薬剤です。臨床試験を含む多くのデータによって、先行バイオ医薬品と同じように使えることが示されています。先行バイオ医薬品よりも安価なため、患者さんの経済的負担や医療費の軽減が期待されます。
バイオシミラーの開発・評価方法
前述した通り、バイオ医薬品である先行バイオ医薬品とバイオシミラーは、ロット間で品質特性にバラツキが生じますが、様々な試験を実施し両者の同等性/同質性は確認されています。
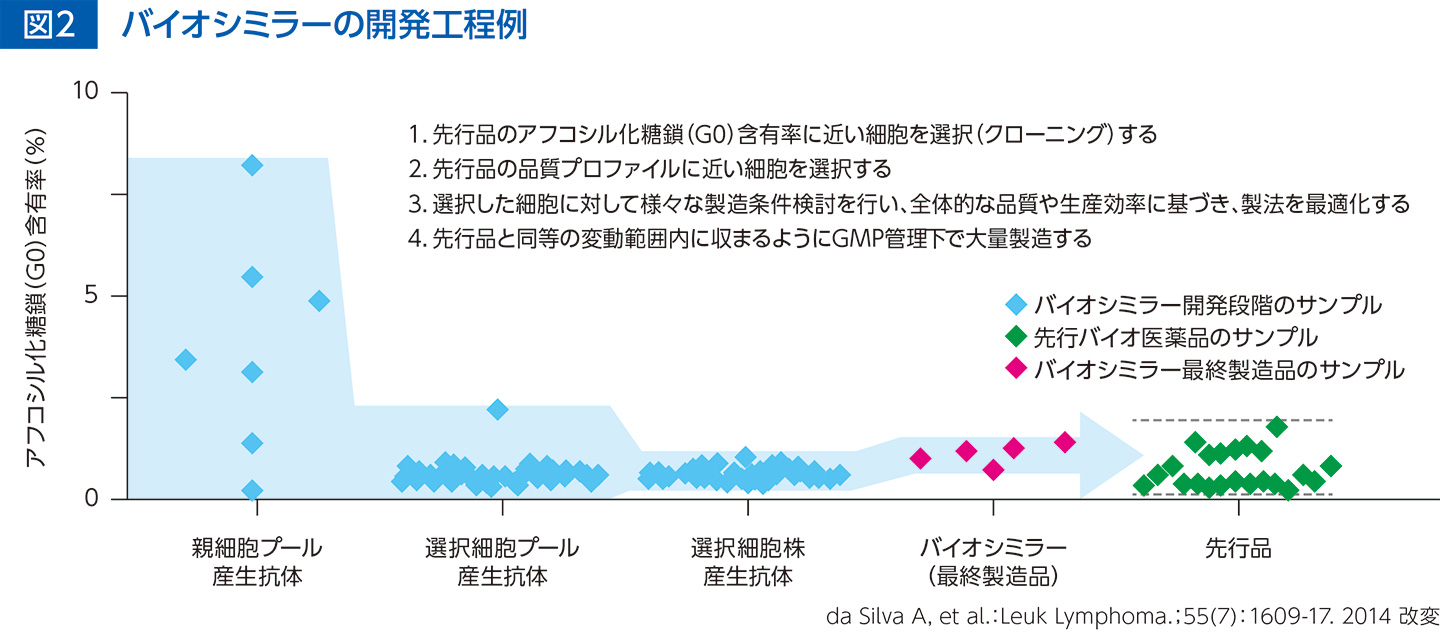
バイオシミラーの開発工程では、先行バイオ医薬品の品質特性の変動範囲とバイオシミラーの品質特性が同等になるよう、適切な指標を使って親株細胞からバイオシミラー製造に用いる細胞を選択します。さらに、選択した細胞の製造条件を検討して、全体的な品質が先行品の変動範囲内に収まる様に最適化します(図2)。
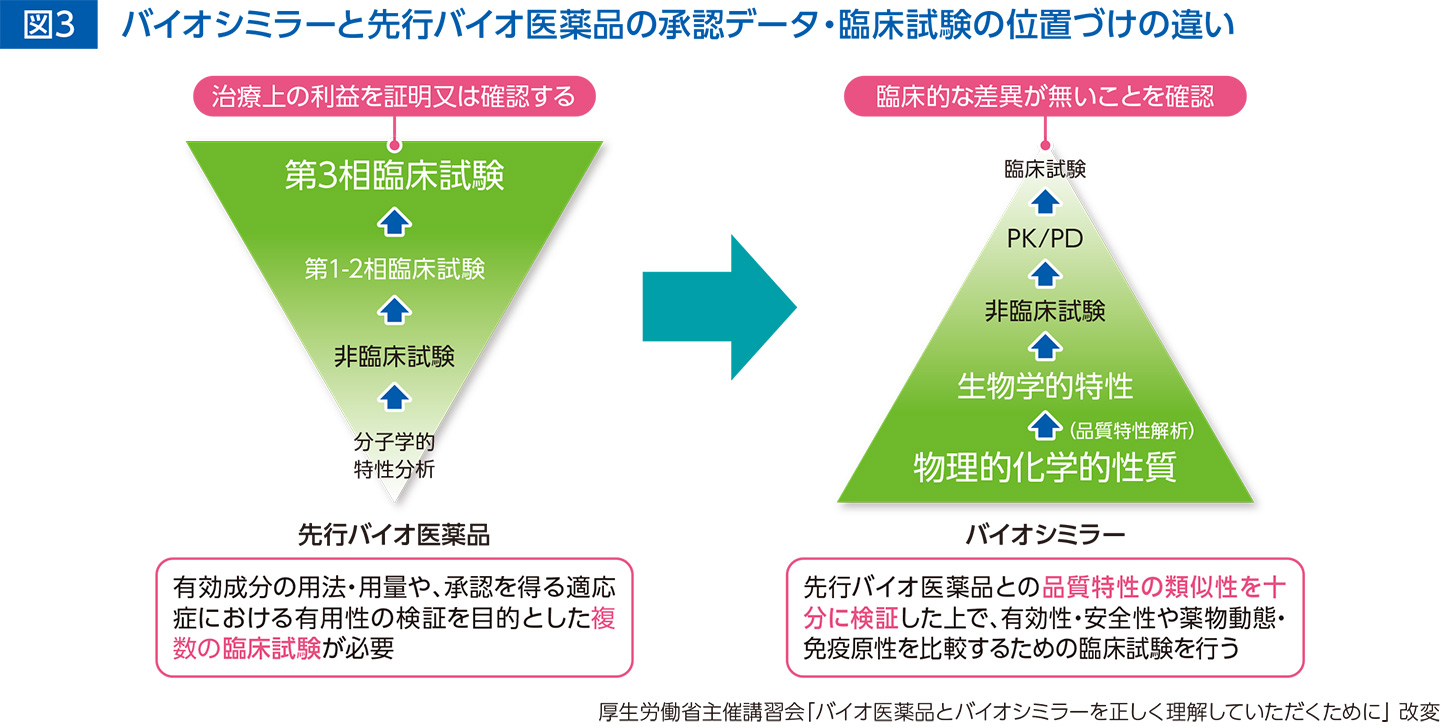
また、物理的化学的性質を評価する品質特性解析や非臨床試験を実施した後、品質特性でわずかな差異がバイオシミラーと先行バイオ医薬品の間で認められたとしても、その差が臨床的に影響を及ぼさないことを確認するため臨床試験を実施しています。
これらの評価は厳格な国の基準の下に実施され、先行バイオ医薬品との同等性/同質性が担保されたバイオシミラーが医療現場に提供されています。さらに、市販後も安全性監視活動等を通じて継続的な評価がなされております(図3)。